Benutzer:NEUROtiker/Labor
Wichtige funktionelle Gruppen in der Biochemie
[Bearbeiten]Häufige Gruppen
[Bearbeiten]- Hydroxylgruppe
- Ether
- Aldehydgruppe
- Ketongruppe
- Carboxylgruppe
- Ester
- Amingruppe
- primär
- sekundär
- tertiär
- quartär
- Carbonsäureamid
- primär
- sekundär
- tertiär
Ein Spezialfall der Carbonsäureamidbindung ist die Peptidbindung, durch die die Aminosäuren in Proteinen miteinander verknüpft sind.
Ein inneres Carbonsäureamid wird Lactam genannt
Spezielle Gruppen
[Bearbeiten]Guanidinogruppe
[Bearbeiten]

Der Stoffgruppe der Guanidine ist die sogenannte Guanidinogruppe oder –funktion gemein. Die Guanidine leiten sich vom Guanidin ab, durch Substitution eines oder mehrerer Wasserstoffatome der Aminogruppen.
In der Biochemie tritt diese Gruppe beispielsweise beim Guanin, beim Biopterin und der Folsäure, die beide ein Pterinring enthalten, und in der Aminosäure Arginin auf.
Die Guanidinogruppe hat einen hohen pKs-Wert von etwa 12 und ist damit eine recht starke Base (etwa vergleichbar mit einem Phosphat-Anion). Die Gruppe liegt selbst im basischen pH noch protoniert vor. Die positive Ladung ist durch Resonanzeffekte über die Gruppe verteilt und wird dadurch stabilisiert.
Ist an ein Stickstoff des Guanidins eine Phosphorylgruppe gebunden spricht man von einem Phosphoguanidin. Diese Verbindungen zeichnen sich durch ein hohes Phosphorylgruppenübertragungspotential aus. Das erklärt im Falle des Kreatinphosphats die Funktion als Energiereserve, indem es seine Phosphorylgruppe bei ATP-Knappheit auf ADP überträgt.
Imidazolgruppe
[Bearbeiten]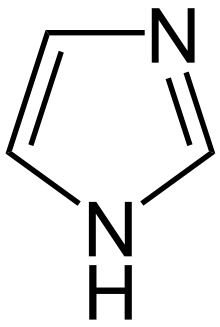
Die Imidazolgruppe leitet sich von der heteroaromatischen Verbindung Imidazol ab.
In der Biochemie findet man die Imidazolgruppe vor allem in Purinen und der Aminosäure Histidin und seinen Derivaten.
Freies Imidazol hat einen pKs-Wert von 7, der pKs der Gruppe im Histidin liegt bei etwa 6. Unter physiologischen Bedingungen liegen also sowohl viele protonierte als auch viele nichtprotonierte Histidinseitenreste vor. Situationsabhängig kann Histidin dadurch als Protonenakzeptor oder -donator dienen. Diese Eigenschaft des Histidins spiegelt bestimmt Funktionen des Histidins: man findet es in der katalytischen Triade einiger Enzyme, wie Lipasen oder Proteinasen, es hat Pufferfunktionen für den pH-Wert des Blutes und wirkt mit bei der durch Sauerstoffbindung induzierten Konformationsänderung des Hämoglobins.
Phosphatgruppe
[Bearbeiten]Phosphatgruppen leiten sich von der ortho-Phosphorsäure ab. Häufig sind Phosphatgruppen an Hydroxylgruppen gebunden. Analog zu den Carbonsäureestern spricht man bei solchen Verbindungen von Phosphorsäureestern. Auch Kondensate der ortho-Phosphorsäure kommen als funktionelle Gruppen vor, vor allem Di- und Triphosphorsäure. Die Gruppen nennt man dementsprechend Diphosphat- und Triphosphatgruppe.
Für die Übertragung von Phosphatgruppen gibt es eine ganze Enzymfamilie, die Kinasen, die sich je nach Substrat in weitere Untergruppen aufteilt.
Phosphatgruppen haben zwei Hauptaufgaben im Organismus. Zum einen dienen sie zum Transport und zur Speicherung von Energie. Hier ist vor allem ATP und GTP zu nennen, bei denen durch Hydrolyse der Phosphorsäureanhydridbindungen Energie freigesetzt wird. Auch die Übertragung auf Zielmoleküle dient häufig der Ermöglichung anschließender endothermer Reaktionen, bei denen die Phosphatgruppen freigesetzt werden.
Zum anderen kann durch die Übertragung von Phosphatgruppen auf Enzyme deren Aktivität moduliert werden, was sowohl zu einer Hemmung als auch zu einer Steigerung der Aktivität führen kann. Dabei können die Seitenketten der Aminosäuren Serin, Threonin und Tyrosin phosphoryliert werden.
Phosphatgruppen haben auch strukturelle Bedeutung, etwa im Rückgrat der Nukleinsäuren oder in den Phospholipiden.
Da sie unter physiologischen Bedingungen immer zumindest teilweise deprotoniert vorliegen, gehen mit Phosphatgruppen immer negative Ladungen einher.
