Benutzer:Ochristi: Anorganische Chemie für Schüler: Säure - Basen - Reaktionen
Wdh. 9. Klasse
[Bearbeiten]Erinnerst Du Dich an die Eigenschaften und Besonderheiten von Säuren und Laugen? Hier noch mal eine kurze Wiederholung, wenn Du Dich nicht mehr erinnerst, dann lese doch noch mal das Kapitel 4.
- Säure und Laugen ätzen.
- sie werden durch Indikatoren für uns erkenntlich gemacht.
- meist verwendet man Universalindikator. Er zeigt bei Säuren die Farbe rot, bei neutralen Lösungen grün und bei Laugen blau.
- Säuren greifen vor allem unedle Metalle an.
- Laugen greifen vor allem organische Substanzen an.
- Natronlauge und Kalilauge liegen als Feststoff vor und müssen vor dem Gebrauch erst aufgelöst werden.
- Säure und Laugen sind „Gegenspieler“, die sich bei gleicher Konzentration in ihrer Wirkung aufheben. Diesen Vorgang nennt man Neutralisation.
- Säuren enthalten in ihrer Formel alle Wasserstoffionen (=Protonen), Laugen sind wässrigen Hydroxidlösungen (enthalten (OH)-)
| Die wichtigsten Säuren und ihre Säurereste | |||
|---|---|---|---|
| Säure | Säurerest | ||
| HF | Flourwasserstoffsäure | Fluorid | |
| HCL | Chlorwasserstoffsäure | Clorid | |
| HBr | Bromwasserstoffsäure | Bromid | |
| HI | Iodwasserstoffsäure | Iodid | |
| H2S | Schwefelwasserstoff(säure) | Sulfid | |
| HNO3 | Salpetersäure | Nitrat | |
| H2SO4 | Schwefelsäure | Sulfat | |
| H2CO3 | Kohlensäure | Carbonat | |
| H3PO4 | Phosphorsäure | Phosphat | |
| HNO2 | Salpetrigesäure | Nitrit | |
| H2SO3 | Schwefeligesäure | Sulfit | |
| H3PO3 | Phosphorigesäure | Phosphit | |
| Die wichtigsten Laugen | |
|---|---|
| Lauge | |
| NaOH | Natronlauge |
| KOH | Kalilauge |
| Ca(OH)2 | Calciumlauge (=Kalkwasser) |
Weitere anorganische Säuren
[Bearbeiten]| Säure | Säurerest | Säurerest | |||||
| Kieselsäure | H2SiO3 | H+ + HSiO3- | H+ + SiO32- | ||||
| Hydrogensilikat | Silikat | ||||||
| Arsensäure | H3AsO4 | 3H+ + (AsO4)3- | |||||
| Arsenat | |||||||
| +I | |||||||
| Hypochlorige Säure (=Chlor(I)-säure) | HClO | H+ + (ClO)- | |||||
| Hypochlorit | |||||||
| +III | |||||||
| Chlorige Säure (=Chlor(III)-säure) | HClO2 | H+ +(ClO2)- | |||||
| Chlorit | |||||||
| +V | |||||||
| Chlorsäure (=Chlor(V)-säure) | HClO3 | H+ +(ClO3)- | |||||
| Chlorat | |||||||
| +VII | |||||||
| Perchlorsäure (=Chlor(VII)-säure) | HClO4 | H+ + (ClO4)- | |||||
| Perchlorat |
Organische Säuren
[Bearbeiten]Organische Säuren kommen in der Natur als Produkt von Tieren oder Pflanzen vor. Sie unterscheiden sich in ihrem Aufbau, da sie nur aus Kohlenstoff-, Wasserstoff- und Sauerstoffatomen bestehen. Ihre Wirkung ist meist etwas schwächer. Einige werden sogar als Lebensmittel eingesetzt. Ihre Formeln sind oft komplizierter:
Typische Säuren sind:
| Säure | Formel | Säurerest |
|---|---|---|
| Essigsäure | C2H4O2 | Acetat |
| Zitronensäure | C6O7H8 | Citrat |
| Ameisensäure | CH2O2 | Formiat |
| Oxalsäure | C2H2O4 | Oxalat |
| Äpfelsäure | C4H6O5 | Malat |
| Ascorbinsäure (=Vit C) | C6H8O6 | Ascorbat |
| Bernsteinsäure | C4H6O4 | Succinate |
| Acetylsalicylsäure (=Aspirin) | C9H8O4 | Acetyl-Salicylat |
Formeln von einigen ausgewählten organischen Säuren
[Bearbeiten](Achtung: freie Elektronenpaare fehlen!)
Monocarbonsäuren: Ameisensäure, Essigsäure


Dicarbonsäuren: Oxalsäure, Bernsteinsäure


Hydroxycarbonsäuren: Äpfelsäure, Zitronensäure


Zur Erinnerung: Der sechseckige Ring steht für eine zyklische Kohlenstoffverbindung mit der Formel C6H6 (Benzol/Benzen)

Säuren mit aromatischen Ring: Acetylsalicylsäure, Ascorbinsäure


Darstellung von Chlorwasserstoff
[Bearbeiten]Material: Gasentwicklungsapparatur, Thermometer, Leitfähigkeitsmessung
V1: Konz. H2SO4 wird aus einem Tropftrichter auf feuchtes NaCl getropft.
V2: Das entstehende Produkt wird über einen Schlauch über eine Glaswanne gefüllt mit Wasser geleitet. Die Stromstärke und der Säuregrad werden gemessen.

| B1 | S1 |
|---|---|
| Es bildet sich ein Gas | HCl ist ein Gas! Säuren können in allen Aggregatzuständen vorkommen |
| das Gefäß wird heiß | Bei der Bildung von HCl wird viel Energie frei |
| B2 | S2 |
|---|---|
| Das Gas löst sich im Wasser | HCl löst sich ausgesprochen gut in Wasser[1]. Es findet eine Reaktion statt |
| Universalindikator färbt sich rot | es hat sich eine Säure gebildet |
| die Temperatur steigt | es liegt eine exotherme Reaktion vor |
| die Leitfähigkeit steigt | es bilden sich Ionen - Ursache muss eine hetero-lytische (=ungleiche) Spaltung des HCl in Ionen sein. |
Wichtig: Wie kann man feststellen, welche Ionen in der Glasschale enthalten sind?
Man gibt Silbernitratlösung zu. Die Zugabe von AgNO3 zeigt eine weiße Trübung.
es sind Chloridionen enthalten, es bildet sich das schwerlösliche Salz Silberchlorid.
Welcher weiterer Stoff kann entstanden sein?
Die Protolyse
[Bearbeiten]Die Auflösung der Frage, welcher Stoff bei der Reaktion von HCl mit entsteht ist nicht so einfach, da ein neues, Dir bis jetzt unbekanntes Teilchen entsteht.
Was wissen wir aus der Vorstunde?
Cl - entsteht H-Cl musste dazu gespalten wurden sein:
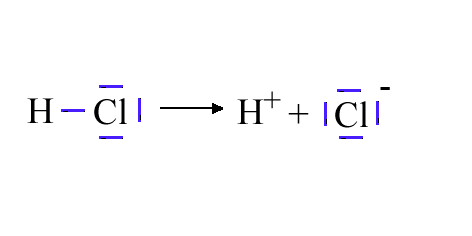
Kurzzeitig entsteht also ein H+ und ein 
Aber wie kommt es zu dieser ungleichen (=heterolytischen) Spaltung des HCl?
HCl und H2O sind Dipole. Das HCl - Wasserstoffatom wird also auch leicht vom H2O - Sauerstoffatom angezogen. Es kann den Bindungspartner wechseln.

Der Sauerstoff des Wasser ist partial negativ geladen. Er übt so eine Anziehungskraft auf das Wasserstoffatom des HCl aus.
Man könnte vereinfacht sagen, das Sauerstoffatom des Wassers flirtet mit dem H (der HCl), welches in Versuchung geführt wird und seinen Partner verlässt.
Die Konsequenz ist, dass HCl heterolytisch getrennt wird. Dabei wird dem elektronegativerem Atom das Elektronenpaar zugeteilt.
Es entstehen H+ und Cl -. Auch das kann man sich vereinfacht vorstellen: bei der Trennung von H und Cl bleibt das gemeinsame Eigentum (also die Elektronen) bei dem Verlassenen.
HCl ist also erst in Verbindung mit Wasser eine Säure. Säure ist demnach nicht eine Stoffeigenschaft, sondern erst das Ergebnis einer Reaktion, bei der Oxoniumionen[2] entstehen.
Aufgabe:
Erstelle Gleichungen für die Protolyse von 8 Säuren!
Zweistufige Protolyse von Schwefelsäure
[Bearbeiten]V: Die Leitfähigkeit von Schwefelsäure und Wasser wird einzeln gemessen. Nun wird vorsichtig etwas Wasser zur Schwefelsäure zugefügt. Die Leitfähigkeit wird gemessen und anschließend ein Diagramm erstellt.
B: Die Leitfähigkeit nimmt zu. Dies geschieht in 2 Stufen.
S: Erst durch die Wasserzugabe findet eine Protolyse statt. Sie geschieht in zwei Schritten, wie man am Leitfähigkeitsdiagramm sehen kann. Es bilden sich nacheinander die Ionen Hydrogensulfat (HSO4-) und Sulfat (SO42-).
Impuls: Schwefelsäure reagiert also in zwei Schritten zu Hydrogensulfat und Sulfat. Beide Säurereste bilden als Feststoff entsprechende Salze (z.B. NaHSO4 und Na2SO4)
Mit Phosphorsäure kann man sogar drei Salze bilden:
NaH2PO4
Na2HPO4
Na3PO4
Zusatzinformationen:
[Bearbeiten]Die Autoprotolyse des Wassers
[Bearbeiten]Wasser reagiert mit sich selbst in geringem Maße zu Hydroxid- und Oxoniumionen.
Allerdings ist in neutralem Wasser die Konzentration der Oxoniumionen nur 0,000.0001 mol/l [10-7 mol/l]. Dies erklärt auch die (wenn auch geringe) Leitfähigkeit von salzfreiem, destilliertem Wasser (siehe dazu Versuch der Ionenleitfähigkeit).
Ist Ammoniak (NH3) eine Lauge?
[Bearbeiten]Eine Messung des pH-Wertes von Ammoniak ergibt einen pH-Wert von ca. 13-14. Dies entspricht dem pH-Wert einer konzentrierten Lauge. Laugen sind wässrige Lösungen von Hydroxidionen (OH-). Diese sind aber in Ammoniak nicht vorhanden!
Ist NH3 eine Lauge, wenn es wie eine Lauge Indikatorpapier blau färbt, aber kein Hydroxid enthält?
Schaut man sich die Reaktion mit Wasser an, kommt man auf die Lösung:
NH3 bildet mit Wasser Hydroxidionen. Es reagiert somit alkalisch. Es ist keine Lauge, reagiert aber wie eine. Aus diesem Grund wurde eine neue Definition notwendig. Da der Begriff Lauge aber schon vergeben war, führten Chemiker den neuen Begriff der Base ein. Basen reagieren alkalisch. Alle Laugen sind auch Basen. Der Begriff Base umfasst aber auch hydroxidfeie Stoffe, wie Ammoniak, die alkalisch reagieren.
Die Definitionen lieferte der dänische Chemiker Johannes Nicolaus Brønsted (1879 -1947):
Eine Säure ist ein Stoff, der Protonen abgibt, also ein Protonendonator.
Ist Natronlauge auch eine Base?
[Bearbeiten]Die Reaktion von Natronlauge mit Salzsäure ist ja aus den letzten Kapiteln bekannt. Es ist eine Neutralisation:
Da es sich bei NaOH und NaCl um Ionen handelt, liegen diese freibeweglich in der Lösung vor:
Wenn man diese Reaktion so betrachtet, sieht man, dass von NaOH eigentlich nur das Hydroxid (=OH- ) reagiert hat:
Säure-Base Reaktionen
[Bearbeiten]Schaut man sich die Reaktion von Natronlauge mit Salzsäure genauer an und ordnet nun den Stoffen die Begriffe Säure und Base zu, so erlebt man eine Überraschung:
| + | + | + | E | |||||
| Base | Säure | Base | Säure |
z.B.:
/
HCl /
Als Faustregel kann man sich dabei merken:
Zusatzinformationen:
[Bearbeiten]
Die Neutralisation
[Bearbeiten]Erinnere Dich:
- Durch Neutralisation kann eine Säure durch Lauge unschädlich gemacht werden (und umgekehrt).
- Die ätzende Wirkung der Säure geht vom Wasserstoff bzw. H3O+ aus.
- Die ätzende Wirkung der Lauge geht vom OH- (=Hydroxid) aus.
OH- muss durch H3O+ unschädlich gemacht werden. Sie bilden H2O.
Bei einer Neutralisation entstehen immer ein Salz und Wasser.
Neutralisation von Salzsäure mit Natronlauge
[Bearbeiten]V: Zu Natronlauge wird Universalindikator gegeben, anschließend wird Salzsäure hinein getropft, während gut gerührt wird.
B: Bei genügender Zugabe von Lauge verfärbt sich der Indikator. Es entsteht bei gutem experimentellem Geschick eine neutrale Lösung, die durch die grüne Verfärbung des Indikators signalisiert wird.
S: In der Natronlauge liegen und -Ionen vor. Hinzu kommen von der Salzsäure und -Ionen. Je mehr man sich dem Neutralpunkt nähert, desto mehr Moleküle und reagieren zu Wasser.
Aufgabe:
- Wenn man nicht weiß, wie viele Teilchen der Säure vorhanden sind, kann man sie durch die Anzahl der Teilchen an Base bestimmen. Woher weiß ich, wann genauso viele Teilchen vorliegen?
Zweistufige Neutralisation
[Bearbeiten]V: Titration von Schwefelsäure mit Kalilauge (ganz und halb). Anschließendes Eindampfen der neutralisierten Lösung und der halbneutralisierten Lösung. Vergleich der beiden Salze nach Aussehen und Eigenschaften.
B: Es entstehen zwei Salze, die sich etwas in ihrem Aussehen unterschieden.
S: Nach Zugabe der Hälfte der Kalilauge entsteht v.a. Natriumhydrogensulfat (1. Stufe). Nach Zugabe der kompletten Menge an Kalilauge ist Natriumsulfat entstanden (2. Stufe).
| 1. Stufe: | NaOH | + | H2SO4 | NaHSO4 | + | H2O | |||
| E | |||||||||
| 2. Stufe: | NaOH | + | NaHSO4 | Na2SO4 | + | H2O | + | E | |
| Salz | + | Wasser |
Gesamtgleichung:
PH-Wert
[Bearbeiten]In der 8. bzw. 9. Klasse hast Du gelernt, dass der pH-Wert den Säuregrad angibt. Er wurde Dir als Messgröße mit den Werten 0-14 vorgestellt.
Nun weißt Du, im Gegensatz zu damals, schon wesentlich mehr über saure Wirkungen von Salzen und weißt, dass die Oxoniumionen für die saure, ätzende Wirkung einer Säure verantwortlich sind. Genau diese werden auch mit dem pH-Wert gemessen.
Das bedeutet, dass z. B. eine Säure mit pH = 2
zehnmal so sauer wie eine Säure mit pH = 3 ist
Um dies genau zu verstehen, musst Du allerdings wissen, was mit dem Begriff „Konzentration“ gemeint ist.
a) Die Konzentration einer Lösung
[Bearbeiten]Die Anzahl an Teilchen (=Stoffmenge) in einer Lösung wird üblicherweise in mol angegeben. Um sie auf die jeweilige Flüssigkeitsmenge zu beziehen, teilt man durch das Volumen:
b) Definition des pH-Werts
[Bearbeiten](dies entspricht dem Säuregrad).
Er ist definiert als negativer dekadischer Logarithmus der Konzentration an Oxoniumionen.
Zur Wiederholung aus dem Matheunterricht:
[Bearbeiten]Logarithmen dienen z.B. dazu, Exponenten auszurechnen.
| 1000 | = | lg103 = 3 | |||
| 100 | = | lg102 = 2 | |||
| 10 | = | lg101 = 1 | |||
| 1 | = | lg100 = 0 | |||
| 0,1 | = | = | lg10-1 = -1 | ||
| 0,01 | = | = | lg10-2 = -2 | ||
| 0,0001 | = | = | lg10-3 = -3 |
Wenn also 1l HCl H3O+ enthält, dann ist die Konzentration
der pH-Wert ist 1
Neutrales Wasser hat, bedingt durch die Autoprotolyse des Wassers, eine H3O+ Konzentration von
pH-Wert = 7
Kann man eigentlich sagen, wie viel mal geringer/ höher die Konzentration an Protonen einer Lösung im Vergleich einer anderen ist?
- Ja, denn von pH 1 zu pH 2 ändert sich die Konzentration von . Sie ist also 10 mal geringer. Vergleicht man eine Lösung mit pH = 10 mit einer mit pH = 7, dann ist demzufolge die Konzentration um den Faktor 1000 höher!
c) Beziehung zwischen dem pH-Wert und dem pOH-Wert
[Bearbeiten]Jetzt könnte man meinen, in Laugen wären keine freien Oxoniumionen vorhanden. Das ist ein Irrtum. Es sind nur sehr wenige. In einer starken Natronlauge befinden sich bei pH-Wert 13 nur H3O+.
In der hoch konzentrierten Lauge befinden sich aber sehr viele Hydroxid () Ionen. Es gilt folgende Beziehung:
wenn also der pH-Wert 13 beträgt sind H3O+ und OH- enthalten.
Mit anderen Worten: In neutralem Wasser liegen H3O+ vor.
pH-Wert ist 7 Wasser ist trotz der H3O+ neutral, da die Konzentrationen c und c gleich sind (beide ). Bei höheren Protonenkonzentrationen ist die Lösung dann sauer. Bei geringeren ist sie alkalisch, da entsprechend die OH- Ionen Konzentration zunimmt.
d) Beispiele aus dem täglichen Leben
[Bearbeiten]Zusatzinformationen
Konzentrierte Salzsäure HCl hat eine Konzentration von ca. . Daraus ergibt sich folgende Verdünnungsreihe:
1000ml entspricht 12 mol HCl/l 500ml HCl + 500ml H2O entsprechen 6 mol HCl/l 50ml HCl + 950ml H2O entsprechen 0,6 mol HCl/l 5ml HCl + 995ml H2O entsprechen 0,06 mol HCl/l 2,5ml HCl + 997,5ml H2O entsprechen 0,03 mol HCl/l
Säuren und Basen im Alltag
[Bearbeiten]
Hier einige Beispiele von pH-Werten bei Alltagsstoffen
| pH-Wert | Beispiel | Säuregrad |
| 0 |
|
sehr sauer |
| 1 |
|
|
| 2 |
|
|
| 3 |
|
schwach sauer |
| 4 |
|
|
| 5 |
|
|
| 6 |
|
|
| 7 |
|
neutral |
| 8 |
|
|
| 9 | schwach alkalisch | |
| 10 | ||
| 11 |
|
|
| 12 | stark alkalisch | |
| 13 | ||
| 14 |
Warum ist Milchsäure auf der Haut so wichtig für Menschen?
[Bearbeiten]Der Säureschutz der Haut besteht vor allem aus Harnsäure und Milchsäure. Er verhindert das Eindringen und Wachsen von Bakterien, Viren und Pilzen auf der Haut, da diese in der Regel keine Säure mögen und auch nicht dort wachsen können, wo schon viele Milchsäurebakterien wachsen. Häufiges Duschen, oder stark alkalische Seifen „schwächen“ allerdings den Säureschutz.
Wie kommt es zu saurem Regen:
[Bearbeiten]Durch Verbrennung fossiler Brennstoffe entstehen Nichtmetalloxidgase wie z.B. Stickoxide, Kohlenstoffdioxid und Schwefeloxide.
z.B.:
- 2NO + O2 2 NO2 + E
- 3 NO2 + H2O 2 H+NO3- + NO + E
- NO + NO2 2 HNO2 + E
- 2NO + O2 2 NO2 + E
Diese Oxide reagieren mit Regenwasser zu Säuren:
z.B.:
- 2NO2 + H2O HNO3 + HNO2 + E
Titration einer Lauge mit Schwefelsäure
[Bearbeiten]V: Zu 20ml Barytwasser (kaltgesättigt!) wird verdünnte Schwefelsäure getropft (+Universalindikator). Die Leitfähigkeit wird gemessen. Wenn der Neutralpunkt erreicht ist (Farbumschlag), tropft man weiter hinzu!

B: Die Leitfähigkeit der Lösung nimmt erst ab, dann zu.

S:
- 1. Warum leitet Bariumhydroxidlösung den e- Strom?
- In wässriger Lösung zerfällt jedes Molekül Ba(OH)2 in drei Ionen: Ba2+ und 2 OH-
- Diese transportieren die elektrischen Ladungen.
- 2. Warum verringert sich die Leitfähigkeit durch Zugabe von H2SO4?
- Ba2++(OH)-22 + 2H+SO42- 2 H2O + Ba2+SO42-
- 1. Ursache: Am Anfang liegen drei Ionen vor. Durch Zugabe von Schwefelsäure verringert sich die Anzahl auf zwei, da zusätzlich Wasser gebildet wird, welches nicht aus Ionen aufgebaut ist.
- 2. Ursache: Es bildet sich das schwerlösliche Salz BaSO4. Diese leitet nicht den Strom, da es nicht gelöst vorliegt.
- Ba2++(OH)-22 + 2H+SO42- 2 H2O + Ba2+SO42-
- 3. Warum ist die Leitfähigkeit am Neutralpunkt minimal?
- Es liegen keine freibeweglichen Ionen vor.
- 4. Warum nimmt die Leitfähigkeit dann wieder zu?
- Die weitere Zugabe von H2SO4 erhöht die Leitfähigkeit, da dessen Ionen den Strom leiten:
2 H+ + SO42- + Ba2+ + 2 OH- 2 H2O + BaSO4
S:
- Es bildet sich das schwerlösliche Salz Bariumsulfat, dadurch sinkt die Leitfähigkeit anfangs. Die Protonen werden neutralisiert. Nach Erreichen des Neutralpunktes steigt die Leitfähigkeit, da nun immer mehr Hydronium und Sulfationen hinzukommen, da verdünnte Schwefelsäure fast vollständig in Ionen zerfallen ist.
Quantitative Neutralisation
[Bearbeiten]In der Chemie unterscheidet man zwischen qualitativen Verfahren, bei denen die Stoffe an sich bestimmt werden, die an einer Reaktion teilnehmen, oder die dabei entstehen und quantitativen Verfahren, bei denen die Stoffmenge von bekannten Stoffen bestimmt wird.
Um die quantitative Neutralisation zu verstehen, fragen wir uns, wie viel Natronlauge (Konzentration c = ) man zum Neutralisieren von 10ml HCl mit der Konzentration c = benötigt.
| HCl: | V = 10ml (=0,01l) | NaOH: | V = ? | ||
| c = | c = | ||||
| n = ? | n = ? | ||||
|
Die Stoffmenge n ist leicht zu berechnen: |
Da wir nicht wissen welches Volumen NaOH benötigt wird, kann auch nicht die Stoffmenge berechnet werden! |
||||
| n = c · V
|
- n = · 0,01l = 0,01mol
Nützt dieses uns Ergebnis, also die vorhandene Stoffmenge (=Anzahl an Säureteilchen, Oxoniumionen) für HCl um den Wert der Stoffmenge für Natronlauge zu bestimmen?
Ja sicher, denn bei der Neutralisation werden alle Oxoniumionen durch Hydroxid der Lauge unschädlich gemacht. Es muss also gelten:
die Stoffmenge an Hydroxid (und somit auch an NaOH) ist auch 0,01mol
VNaOH = =
Damit nun alle Eventualitäten berechnet werden können (also auch z.B., welche Konzentration muss eine Lauge haben, damit genau 100ml verwendet werden), substituieren wir n in der Gleichung durch c · V
cSäure · VSäure = cLauge · VLauge
Mit dieser Gleichung lassen sich durch Umstellen alle Fälle berechnen!
Titration einer Salzsäure unbekannter Konzentration
[Bearbeiten]V: 10 ml Salzsäure werden mit einer bestimmten Menge Natronlauge () neutralisiert.
| C in | V in l | |
| HCl | x | 0,1 |
| NaOH | 0,1 | 0,1 |
Im Falle, dass alle Oxoniumionen der HCl mit allen Hydroxid der NaOH reagiert haben, liegen genauso viele Teilchen HCl wie NaOH vor!
- nHCl = nNaOH
n = c * V c HCl * V HCl = cNaOH * VNaOH c HCl =
Überprüfe Dein Ergebnis durch eine Messung!
Aufgaben
[Bearbeiten]1. Es sollen 10ml Salzsäure () mit Kalkwasser neutralisiert werden. (Kalkwasser ist eine wässrige Lösung von Calciumhydroxid)
- a) Stelle die Reaktionsgleichung auf
- b) Bestimme die notwendige Stoffmenge an Calciumhydroxid.
- c) Zur Calciumhydroxid Herstellung liegt Calciumoxid vor. Wie stellt man aus Calciumoxid Calciumhydroxid dar? (Bedenke: Calciumoxid
ist ein Metalloxid)
- d) Stelle dazu die Reaktionsgleichung auf. Wie nennt man diesen Vorgang?
- e) Welche Masse an Calciumoxid muss abgewogen werden, damit die notwendige Stoffmenge an Calciumhydroxid vorliegt?
- f) Neutralisiere die Säure indem Du tropfenweise Dein selbst hergestelltes Kalkwasser hinzufügst. Füge einen Indikator zu und beobachte (In welcher Folge ändert sich die Indikatorfärbung?)
2. Statt Salzsäure werden 10ml Phosphorsäure () verwendet. Berechne die notwendige Menge an CaO!
Zusatzinformationen:
[Bearbeiten],
Musterlösung Aufgabe 1
[Bearbeiten]a) Reaktionsgleichung:
| Ca(OH)2 | + | 2HCl | 2 H2O | + | CaCl2| style="border:none; padding:0em 0.5em 0em 0.5em; " |+ | E |
b) Die notwendige Stoffmenge an Calciumhydroxid:
- Wie man sieht entsprechen die Stoffmengen sich nicht. Zum Neutralisieren der beiden OH- eines Moleküls Ca(OH)2 braucht man zwei Moleküle HCl:
(1) Es gilt also : n = 2n HCl
(2) Anzahl an vorliegenden Säureteilchen: nHCl = cHCl · VHCl
aus (1) und (2) folgt
man benötigt zur Neutralisation also 0,00005 mol Ca(OH)2. Diese reagieren mit 0,0001mol HCl
c) Wie stellt man aus Calciumoxid Calciumhydroxid dar?
- Durch Zugabe von Wasser. Metalloxide und Wasser bilden Laugen!
- CaO + H2O Ca(OH)2 +E
d) Welche Masse an Calciumoxid muss abgewogen werden, damit die notwendige Stoffmenge an Calciumhydroxid vorliegt?
- Wir benötigen 0,00005 mol Ca(OH)2
- 0,00005 mol CaO + 0,00005 mol H2O 0,00005 mol Ca(OH)2 +E
Es müssen 0,0028g CaO abgewogen werden. Diese werden mit einer beliebigen (!) Menge Wasser aufgelöst und für den Versuch verwendet. Sie neutralisieren genau die vorhandene Menge an HCl.
Zusammenfassung: Säure und Basen-/Laugenbildung
[Bearbeiten]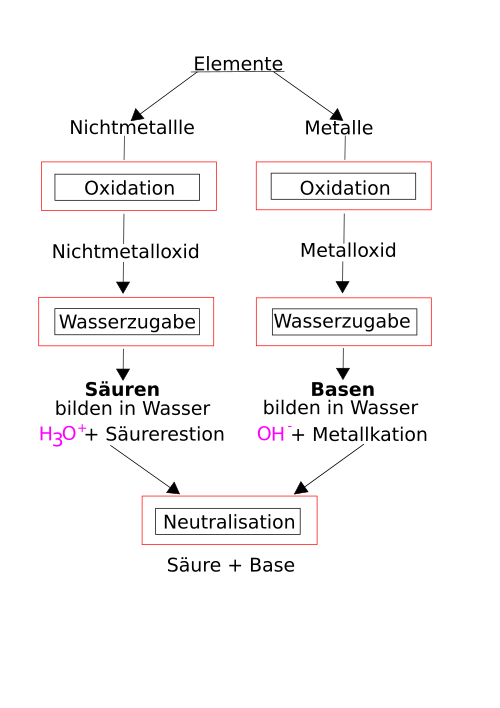
Wichtige Definitionen
[Bearbeiten]Arrhenius:
Eine Säure ist...
Eine Lauge ist...
Brönstedt:
Eine Säure ist...
Eine Base ist...
Eine Protolyse ist...
Das Kennzeichen einer Säure-Base Reaktion ist...
Eine Neutralisation ist...
Die Einführung des Konzeptes „Base“ wurde notwendig, da...
Salze entstehen z.B. durch...
Wiederholungsfragen Säure, Lauge, Base
[Bearbeiten]- Definiere die Begriffe Säure und Lauge und wiederhole alle Säuren und ihr Säurereste
- Was ist ein Indikator? Erkläre, welche positiven Eigenschaften ein Stoff haben muss, um ein Indikator zu sein und nenne dir bekannte Indikatoren.
- Wie kann man Chlorwasserstoff im Labor darstellen? Wie Salzsäure?
- Was versteht man unter Protolyse? (Autoprotolyse?)
- Welcher Zusammenhang besteht zwischen Säuren, der Säurewirkung und Oxoniumionen (bzw. Protonen)?
- Definiere Säure, Lauge/ Base nach Arrhenius und Brönsted. Warum hat Brönstedt das System der Lauge erweitert? (Tipp: nenne zuerst 5 Laugen und 15 Basen!)
- Warum spricht man bei Säure - Base Reaktionen auch vom „Donor-Akzeptor-Prinzip“
- Begründe mit einer Reaktionsgleichung, warum auch alkalisch wirken kann und freisetzt, obwohl es doch kein Hydroxid in der Formel enthält!
- Welche Stoffe werden durch Säuren, welche durch Laugen angegriffen?
- Was versteht man unter dem „korrespondierenden Säure-Base Paar“?
- Was versteht man unter dem pH-Wert? Definiere und erkläre den genauen Zusammenhang zwischen pH-Wert und der Konzentration
- Nenne 5 Dinge aus dem tägliche Leben, die eine Säure sind
- Mit welcher Formel kannst Du berechnen, wie viel Lauge zu einer bestimmten Menge Säure hinzu gegeben werden muss.
- Bestimme die Konzentration einer Lösung, die aus 95ml Wasser und 1mol Salz enthält
- Wie viel Wasser muss zu 0,121 mol Kochsalz zugegeben werden, damit eine Lösung mit c = 0,05 mol/l entsteht?
- Berechne: Es sollen 10ml Salzsäure (n= 0,001 mol/l) mit Kalkwasser neutralisiert. Bestimme die notwendige Stoffmenge an Calciumhydroxid.
- Berechne: Es sollen 10 ml Phosphorsäure (n= 0,001mol/l) neutralisiert werden. Berechne für Kaliumhydroxid und für Kalkwasser.











![{\displaystyle c={\frac {n}{V}}\qquad \left[{\frac {mol}{l}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed81fec40312bfd915b5a636f30f64ee7b00839b)


































