Biochemie und Pathobiochemie: Hämoglobin
Allgemeines
[Bearbeiten] |
 |
 |
 |
Der rote Blutfarbstoff Hämoglobin (Hb) ist für den Sauerstofftransport von der Lunge in die Peripherie verantwortlich. Das Hämoglobin befindet sich in den Erythrozyten (MCH: ca. 27 - 34 pg Hämoglobin pro Erythrozyt) und bildet etwa 1/3 der Masse der Erythrozyten (MCHC: 320 - 360 g/l). Im Vollblut bildet Hämoglobin die Hauptmasse an Protein (Hb: 14 - 18 g/dl, im Vergleich dazu das Serumprotein: 6,5 - 8,5 g/dl).
Aufbau
[Bearbeiten]Das Hämoglobin-Molekül ist ein Tetramer aus 4 Untereinheiten. Jede Untereinheit besteht aus einem Häm und einem Protein-Anteil, der Globinkette. Die Globinkettengene (α, β, γ, δ, ε, ξ) werden abhängig vom Entwicklungsstadium exprimiert. Die in utero vorherrschenden Hämoglobine besitzen eine höhere Sauerstoffaffinität, um den Sauerstofftransfer vom mütterlichen ins kindliche Blut an der Plazentarschranke zu unterstützen.
HB-Typen nach Art der Globin-Kette
[Bearbeiten]- HbA1 (α2β2) - 97 % des Hb beim Gesunden
- HbA2 (α2δ2) - 2,5 % des Hb beim Gesunden
- HbF (α2γ2) - Fetales Hämoglobin
- Gower 1 (ξ2ε2) - Embryonales Hämoglobin
- Gower 2 (α2ε2) - Embryonales Hämoglobin
- Hämoglobin Portland (ξ2γ2) - Embryonales Hämoglobin
Funktionen
[Bearbeiten]- Sauerstofftransport. 1 g Hb bindet in vivo maximal 1,34 ml O2 (Hüfner-Zahl). Umgerechnet in mmol heißt das: 1 mmol Tetramer (64,5 g) bindet maximal 86,34 ml O2.
- Säure-Puffer durch Bindung von H+ v.a. im Kapillarbett. Protonen werden bei der Umwandlung von CO2 in HCO3- durch die Carboanhydrase frei. Im Lungengefäßbett erfolgt die Rückreaktion und Abgabe von Kohlendioxid zur Abatmung.
- Bindung von CO2 über Carbaminobindungen und Transport Richtung Lunge (etwa 20 % des CO2). Desoxygeniertes Hb bindet CO2 besser als oxygeniertes Hb.
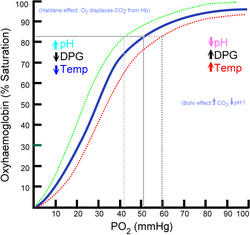
Kooperativität und Sauerstoffbindungskurve
[Bearbeiten]Normalerweise würde man beim Hämoglobin wie bei vielen Enzymen eine hyperbolische Substrat-Bindungskurve erwarten. Real bietet sich jedoch ein sigmoider Verlauf. Dies erklärt sich aus der Kooperativität der vier Untereinheiten. Bindet das Häm einer Untereinheit ein Molekül Sauerstoff (O2), so kommt es zu einer Konformationsänderung der vier miteinander verbundenen Hb-Untereinheiten, die die Anlagerung von weiteren Sauerstoffmolekülen an die anderen Untereinheiten erleichtert. Dadurch verläuft die O2-Bindungskurve im physiologischen Bereich der Sauerstoffpartialdrücke steiler und das Hämoglobin kann im Lungenkreislauf leichter mit Sauerstoff beladen werden und ihn im peripheren Gewebe leichter abgeben.
Modulation des Sauerstoffbindungskurve
[Bearbeiten]Das Verhalten des Hämoglobins wird noch dadurch optimiert, dass die Sauerstoffbindungskurve von verschiedenen Effektoren beeinflusst werden kann. Zu einer Rechtsverschiebung der Kurve im peripheren Kapillarbett mit Abnahme der O2-Affinität bzw. Erleichterung der O2-Abgabe kommt es durch:
- die Bindung von Protonen und CO2 (bekannt als sog. Bohr-Effekt).
- die Bindung von 2,3-Bisphosphoglycerat. 2,3-BPG entsteht in einem Nebenweg der Glycolyse aus 1,3-BPG. Es bindet allosterisch v.a. an Desoxy-Hb und stabilisiert es dadurch. Fetales HbF bindet 2,3-BPG geringer als adultes Hb, da es eine höhere Sauerstoffaffinität braucht, um in der Plazenta genügend Sauerstoff aus dem mütterlichen Kreislauf abzuziehen.
- steigender Temperatur (z.B. im arbeitenden Muskel)
Eine Linksverschiebung der Kurve in der Lungenstrombahn mit Erhöhung der O2-Affinität kommt dadurch zustande, dass hier die Protonen- und CO2-Konzentration abnimmt.
Strukturell verwandte Proteine
[Bearbeiten]Das Myoglobin dient als Sauerstoffspeicher im Muskel (v.a. in roten Typ-I-Muskelfasern). Es entspricht in seinem Aufbau einer Hämoglobin-Untereinheit und zeigt daher keine Kooperativität. Myoglobin besitzt eine höhere Sauerstoffaffinität als Hämoglobin.
Pathobiochemie und Labormedizin
[Bearbeiten]- Anämie - Einen Mangel an Hämoglobin bzw. Erythrozyten nennt man Anämie (Blutarmut). Diese kann z.B. durch Blutbildungsstörungen bedingt sein (Eisen-Mangel, Folat-Mangel, Cobalamin-Mangel, Vergiftung mit Benzol oder Blei, erbliche Defekte wie die Thalassämie, Eisenverwertungsstörungen bei SIRS, Knochenmarksverdrängung), durch erhöhte Verluste (Blutung) oder vorzeitigen Abbau (Autoantikörper, Membrandefekte (Kugelzellanämie), Enzymdefekte wie z.B. dem (G6PD-Mangel)).
- Sichelzellanämie (OMIM) - Das Hb ist qualitativ verändert (HbA1 -> HbS). Die Mutation der β-Kette (Ersatz von Glutamat gegen Valin in Position 6) bewirkt eine Polymerisation des Hämoglobins v.a. im venösen Blut und damit ein Aussicheln der Erythrozyten. Die Mutation bewirkt eine höhere Malaria-Resistenz und konnte sich wahrscheinlich deswegen so gut verbreiten.
- Thalassämie - Das Hb ist quantitativ verändert. Die Synthese einer oder mehrerer Hb-Ketten ist gestört. Je nach betroffener Globinkette und Schweregrad kommt es zur ineffektiven Erythropoese (Blutbildung) mit Anämie (Blutarmut), einer vermehrten Bildung fetaler und embryonaler Hämoglobine, Ikterus (Gelbsucht), Gallenstein-Bildung durch vermehrten Bilirubin-Anfall und Knochenveränderungen sowie Leber- und Milzvergrößerung durch die Expansion der Erythropoese. β-Thalassämien (OMIM) führen schneller zu Symptomen als α-Thalassämien (OMIM), da es vier α-Kettengene, aber nur zwei β-Kettengene gibt.
- HbA1c - Die nicht-enzymatische Glycosylierung des Hämoglobins korreliert mit dem Blutzuckerspiegel. Aufgrund der langen Erythrozyten-Lebensdauer von ca. 120 Tagen kann der HbA1c-Wert als „Blutzuckergedächtnis“ angesehen und als Indikator für die Güte der mittelfristigen Blutzuckereinstellung beim Diabetiker genutzt werden.
Weblinks
[Bearbeiten]
Haben Ihnen die Informationen in diesem Kapitel nicht weitergeholfen?
Dann hinterlassen Sie doch einfach eine Mitteilung auf der Diskussionsseite und helfen Sie somit das Buch zu verbessern.
