Lehrbuch der Biochemie: Biomoleküle: Proteine
Aufbau von Proteinen
[Bearbeiten]Proteine bestehen aus einer oder mehreren langen Aminosäureketten. Diese Ketten können oft mehrere tausend AS lang sein. Daraus ergeben sich hochkomplexe und vielfältige räumliche Strukturen. Die Strukturen und die Eigenschaften der endgültigen Proteine werden im Wesentlichen nur von den einzelnen Aminosäuren bestimmt. Die Seitenketten der Aminosäuren bestimmen vorallem die Eigenschaft der Wasserlöslichkeit. Im Cytoplasma frei bewegliche Enzyme sind meist hydrophil. An der Oberfläche dieser Enzyme sind somit meist Aminosäuren mit hydrophilen Seitenketten (Serin, Threonin, Glutamin, …). Membranpoteine sollten hingegen fettlöslich sein, da sie meist in der Doppellipidschicht der Membran verankert sind. Diese Proteine besitzen an ihrer Oberfläche meist Aminosäuren mit hydrophober/lipophilen Seitenketten (Valin, Leucin, Phenylalanin, …).
Faltung von Proteinen
[Bearbeiten]Wie schon erwähnt sind Proteine Gebilde von äußerst komplexer räumlicher Struktur. Proteine werden als Kette aus einzelnen Aminosäuren gebildet. Diese Aminosäureketten bilden von sich aus nun eine 3D-Struktur, wobei die Gesamtstruktur meist aus verscheidenen Grundstrukturmuster wie z.B. β-Faltblatt oder α-Helix (mehr dazu weiter unten) besteht. Der Vorgang dieser Strukturausbildung wird als Faltung bezeichnet.
Bedeutung der Struktur, Faltung und Sequenz für Proteine
[Bearbeiten]Ein Großteil der Proteine dient als Enzym, als Transportsystem oder als Transmembranprotein. Diese Proteine verbindet die Eigenschaft, dass sie einen kleinen Bereich besitzen, der mit dem jeweiligen Substrat interagiert. Der restliche Teil des Proteins dient vorwiegend der Erhaltung der Struktur, der Beeinflussung der Wasser-/Fettlöslichkeit oder sie übernehmen regulatorische Funktionen für das Protein. Findet nun eine inkorrekte Faltung oder ein zusätzlicher Einbau einer Aminosäure bzw. die Elemination (=Löschung, herausnehmen) oder Substitution (Ersatz) einer Aminosäure statt, ändern sich je nach Ort der Änderung die Eigenschaften des Proteins. Findet diese Änderung zum Beispiel im katalytischen Zentrum von Enzymen statt, verlieren diese Enzyme oft gänzlich ihre Aktivität bzw. führt diese Veränderung in einigen Fällen bloß zu einer Verringerung der Aktivität. Findet diese Änderung an einem rein strukturellen Element des Proteins statt, kann in vielen Fällen keine signifikante Änderung der Eigenschaften festegestellt werden. Die Beschreibung dieser Strukturen wollen wir uns jetzt etwas genauer ansehen: Es gibt 4 „Hauptbeschreibungsebenen“, je nachdem, wie detailliert man ein Protein betrachtet. Im Folgenden gehen wir auf diese 4 Grundbegriffe ein.
Die Peptidbindung
[Bearbeiten]Zwei AS können reagieren und sich mittels "Peptidbindung" aneinanderknüpfen. Dabei wird ein -Molekül der Säuregruppe der ersten AS und ein Proton der Aminogruppe der zweiten AS entfernt (wird schlussendlich zu ). An der „Nahtstelle“ verbindet sich dann das C-Atom der ersten mit dem N-Atom der zweiten AS.
An das entstehende Molekül kann in gleicher Weise nun erneut eine weitere AS binden. So entstehen ganze Ketten von Aminosäuren, die Peptidketten (kurz: Peptide) genannt werden. Ab einer Länge von etwa 100 AS spricht mann dann von einem „Protein“.

Primärstruktur
[Bearbeiten]Unter der Primästruktur von Proteinen versteht man die lineare Aminosäuresequenz, also die Abfolge der einzelnen Aminosäuren in der Kette. Vereinbarungsgemäß werden die Aminosäuren vom N-Terminus zum C-Terminus durchnummeriert.
Die weltweit erste Sequenzierung fand am Protein „Insulin“ statt. (Frederick Sanger, 1953). Die Primärstruktur, also lediglich die Reihenfolge der Aminosäuren, legt bereits die Faltung, also die endgültige räumliche Struktur der Proteine fest. Durch die räumliche Struktur wird gleichzeitig auch die Funktion des Proteins (Insulin ist zB das „Ich bin satt“-Protein) festgelegt.
Was ein Protein im menschlichen Körper tut und wie es wirkt steht also bereits in der Primärstruktur fest!
Sekundärstruktur
[Bearbeiten]Durch verschiedene Wechselwirkungen (H-Brücken, Disulfidbrücken, …) lagern sich Teile der Kette oft zu charakteristischen Formen zusammen. Unter Sekundärstruktur muss man sich noch keine räumliche Anordnung der Aminosäure vorstellen, vielmehr geht es um die Abfolge der strukturellen Grundelemente, wie vor allem alpha-Helix und beta-Faltblatt. Es gibt noch eine Reihe anderer Strukturelemente, diese sind jedoch bei weitem weniger häufig als die Erstgenannten.
α-Helix
[Bearbeiten]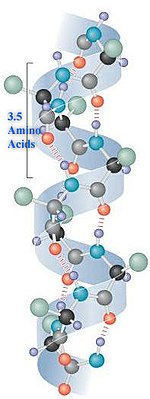
.
Auf Englisch: Alpha Helix
β-Faltblatt
[Bearbeiten]
β-Faltblatt
Auf Englisch: Beta Sheet
β-Haarnadel
[Bearbeiten]Hierbei handelt es sich um ein „Turn-Around“ der Kette meist um ca. 180°. (Auch Schleife genannt)
Supersekundäre Strukturen
[Bearbeiten]Häufig kommen charakteristische Anordnungen von Sekundärstrukturen in einem Protein hintereinander ab. Der Übersicht halber hat man diesen Gebilden einen extrigen „Zwischenplatz“ zwischen den Sekundär- und den Tertiärstrukturen eingeräumt.
Beispiele für Supersekundäre Strukturen sind:
- Helix-Schleife-Helix
- Bündel von 4 α-Helices
- β-Faltblatt - α-Helix - β-Faltblatt - Anordnung
Tertiärstruktur
[Bearbeiten]
Die Tertiärstruktur beschreibt bereits die komplette räumliche Anordnung einer Aminosäuresequenz. Falls ein Protein nur aus einer Aminosäuresequenz besteht, ist dieses Protein bereits mit der Tertiärstruktur vollends beschrieben.
Quartärstruktur
[Bearbeiten]
Die Aminosäurekette wird in den Zellen von den Ribosomen gebildet. In unserer DNA ist im wesentlichen nur die Aminosäuresequenz gespeichert. (Abgesehen von etwaigen Signalsequenzen, welche veranlassen, dass das Protein verschiedener posttranslationaler Modifikationen unterzogen wird. Diese Signalsequenzen werden in der Regel vor, nach oder während dieser Modifikation entfernt.) Diese Aminosäuresequenzen falten sich von sich aus (und unter den richtigen Umgebungsbedingungen) zusammen und bilden somit ihre Sekundär- und Tertiärstruktur. Falls nun in der Zelle zwei, oder mehrere solche gefalteten Aminosäuresequenzen zusammengefügt werden, spricht man von einer Quartärstruktur. Die einzelnen Tertiärstrukturen werden auch „Untereinheiten“ genannt. Ein berühmter Vertreter von Proteinen mit Quartärstruktur ist das Hämoglobin, das aus 4 globulären Untereinheiten mit je einem Häm als prosthetische Gruppe.

Detail am Rande:
Eine weit verbreitete Methode zur Untersuchung von Proteinen ist die Gelelektrophorese. Diese kann in denaturierende Gelektrophorese (sehr bekannt die Sodiumdodecylsulfat = SDS-Gelelektrophorese) und in die nicht denaturierende oder native Gelelektrophorese unterteilt werden. Bei der denaturierenden Gelelektrophorese werden die Wasserstoffbrücken und, die Disulfidbrücken zwischen den Aminosäurensequenzen aufgelöst. Besteht nun ein Protein aus zwei oder mehreren Untereinheiten, sind diese jeweils als eigene Bande auf dem Gel erkennbar. Bei der nativen Geleketrophorese ist nur eine Bande pro Protein sichtbar.
Funktionen von Proteinen
[Bearbeiten]Proteine können in allen Organismen die verschiedensten Funktionalitäten haben.
Beispiele:
- Enzyme
- Hormone
- Co-Faktoren
- Toxine (und damit teilweise auch Antibiotika)
- Biomasse (Muskelgewebe, Kollagen, Bindegewebe, …)
- …
Auf die einzelnen Punkte wird in späteren Kapiteln des Buches eingegangen.


