Praktikum Anorganische Chemie/ Nickel
Nickel
[Bearbeiten]
(2) schwarzes Nickelsulfid,
(3) hellgrünes Nickelhydroxid,
(4) blaues Hexaaminnickel,
(5) basische grüne Carbonatsalze wechselnder Zusammensetzung
Nickelsalze fallen im Trennungsgang in der Ammoniumsulfidgruppe als schwarze Sulfide aus.
- Nickel(II)-Ionen reagieren mit Ammoniumsulfid zu Nickel(II)sulfid und Ammonium-Ionen.
Des Weiteren ist die Fällung des Hydroxids möglich, das man an seiner spezifisch grünen Farbe erkennen kann. Als Fällungsmittel wird meist Natronlauge verwendet.
- Nickel(II)-Ionen reagieren mit Natronlauge zu grünem, wasserunlöslichem Nickel(II)hydroxid und Natrium-Ionen.
Durch Zugabe von starken Oxidationsmitteln wie Chlor oder Brom, jedoch nicht mit Wasserstoffperoxid, geht das grüne Hydroxid in ein höheres, schwarzes Oxid über.
- Grünes Nickel(II)hydroxid reagiert mit Brom zu schwarzem, wasserunlöslichem Nickel(IV)oxid und Bromwasserstoff.
Wird zu einer Probelösung, die Nickel(II)-Ionen enthalten soll, Ammoniak-Lösung zugetropft, kann man beobachten, das sich zuerst ein grüner Niederschlag von Nickel(II)-hydroxid bildet, der bei Überschuss von Ammoniak sich unter Blaufärbung wieder auflöst.
- Nickel(II)-Ionen reagieren im wässrigen Milieu mit Ammoniakwasser zu grünem, wasserunlöslichem Nickel(II)hydroxid und Ammonium-Ionen.
- Nickel(II)-Ionen reagieren bei Überschuss von Ammoniakwasser zu blauen, wasserlöslichen Hexaaminnickel(II)-Ionen und Hydroxid-Ionen.
Nachweis mit DAD
[Bearbeiten]| Nachweisreaktion | |
|---|---|
| Reaktionstyp: | Chelatkomplexbildung |
| pH | >7 alkalisch |
| Indikation | himbeerroter Niederschlag |
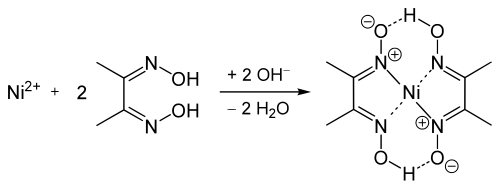
Durchführung
[Bearbeiten]Man versetzt die zuvor alkalische gemachte Analysenlösung mit einer alkoholischen Lösung von Diacetyldioxim (=Dimethylglyoxim), die auch Tschugajews Reagens genannt wird. Es bildet sich ein himbeerroter voluminöser Niederschlag, der in verdünnten Mineralsäuren wieder zerfällt. In Natronlauge und in Gegenwart von starken Oxidationsmitteln wie Peroxodisulfat erscheint eine ebenfalls intensiv rote, jedoch lösliche Nickel(III)-Verbindung.





![{\displaystyle \mathrm {Ni(OH)_{2}+6\ NH_{3}\longrightarrow [Ni(NH_{3})_{6}]^{2+}+2\ OH^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d3dc3dab60788331ef83ba195b23690087e644d)