Schilddrüse: Biochemie
Zurück zur Schilddrüse

Iod
[Bearbeiten]siehe Schilddrüse: Iod
Iod im menschlichen Körper
[Bearbeiten]Resorption im Dünndarm als Iodid, negatives geladenes Iod-Atom
[Bearbeiten]Iod Transport in die SD-Zelle: Natrium-Iodid Symporter NIS
[Bearbeiten]Der Natrium/Iodid-Symporter (NIS) ist ein langkettiges Eiweiß. Es sitzt in der Membran von Schilddrüsenfollikelzellen und sorgt für den Transport von Iod in die Schilddrüsenzellen. Das Protein des Natrium-Iodid Symporters wurde mittlerweile kloniert. Es besteht aus 643 Aminosäuren. Der NIS bewerkstelligt den aktiven Transport von Iodid in die Schilddrüse, man findet ihn aber auch in einer Reihe extrathyreoidaler Organe, insbesondere in der milchproduzierenden Brustdrüse der Frau.
Der NIS wird
- durch TSH hochreguliert
- durch mäßige Ioddosen offensichtlich herunterreguliert
- durch Perchlorat inhibiert.
Oxidation zu Iod
[Bearbeiten]Synthese von T3 und T4
[Bearbeiten]Übersicht
[Bearbeiten]
Das Thyroxin-Molekül T4 ist an vier Stellen mit Iod besetzt (Tetraiodthyronin = 4-Jod-Schilddrüsenhormon ). T3 ist an 3 Stellen mit Iod besetzt (Triiodthyronin = 3-Jod-Schilddrüsenhormon).
Das Iod wird von der Schilddrüse aus dem Blut abgefangen und konzentriert. Die „Iodierung“ erfolgt stufenweise und stets am Rest der Aminosäure Tyrosin. Über die Vorstufen Monojodtyrosin und Diiodtyrosin (genauer: 3,5-Dijod-L-Tyrosin) entsteht durch Kopplung zweier Moleküle zunächst T4. Daraus wird unter Verlust eines Iodatoms T3 gebildet. Zur Speicherung werden die Hormone an Transporteiweiße, insbesondere w:Thyroxin-bindendes Globulin (TBG), gebunden.
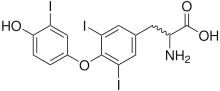
Im Normalfall wird das Iod durch den Abbau der Hormone durch Darm und Niere wieder ausgeschieden. Deswegen ist der gesunde Körper auf ständige, ausreichende Iodzufuhr angewiesen.
Die Ausschüttung von Thyroxin wird verstärkt, wenn der Thyroxinspiegel im Blutplasma zu stark absinkt und umgekehrt. Die Aufrechterhaltung des Schilddrüsenhormonspiegels wird dadurch geregelt.
Siehe auch Wikibuch Biochemie
Tyrosin
[Bearbeiten]
Tyrosin ist in seiner natürlichen L-Form eine nichtessenzielle proteinogene Aminosäure, die in den meisten Proteinen vorkommt, in großen Mengen im Casein. Tyrosin ist Ausgangssubstanz für die Biosynthese von Katecholaminen ( wie zb Adrenalin) , Melanin und Thyroxin.
Vorkommen
[Bearbeiten]Tyrosin kommt im Körper als Zersetzungsprodukt von Proteinen vor. Säugetiere können Tyrosin aus der essentiellen Aminosäure Phenylalanin synthetisieren, welche mit der Nahrung aufgenommen wird.
Funktionen
[Bearbeiten]Im Nebennierenmark werden aus L-Tyrosin die Hormone Adrenalin und Noradrenalin gebildet und bei Bedarf direkt an das Blut abgegeben.
Die Bildung der Schilddrüsenhormone T3 und T4 im Kolloid der Schilddrüse beruht ebenfalls auf Tyrosin-Untereinheiten.
Krankheiten
[Bearbeiten]Auch in Folge einer Phenylketonurie (PKU) kann es zu einem Mangel an Tyrosin kommen. Über Nahrung aufgenommenes Phenylalanin kann nicht korrekt zu Tyrosin synthetisiert werden, welches dem Körper infolgedessen medikamentös zugeführt werden muss, da es ansonsten zu einer Unterproduktion von Melanin (Albinismus) und Thyroxin (Kretinismus) kommt. Ebenso kommt es zu Problemen bei der Herstellung von Katecholaminen.
Literatur
[Bearbeiten]- Biochemie, Berg/Tymoczko/Stryer, 5. Auflage, Spektrum Akademischer Verlag GmbH Heidelberg 2003, ISBN 3827413036
Monoiodtyrosin
[Bearbeiten]Monoiodtyrosin (MIT), veraltet auch Monojodtyrosin (MJT), ist eine nicht-proteinogene Aminosäure, die aus der proteinogenen Aminosäure Tyrosin durch Iodierung entsteht. Es ist im menschlichen Körper die Vorstufe der Schilddrüsenhormone T3 und T4.
Biosynthese (Mensch)
[Bearbeiten]Monoiodtyrosin wird in der Schilddrüse aus L-Tyrosin und Iodid gebildet. Das L-Tyrosin liegt dabei in Form von an Thyreoglobulin gebundenen Tyrosyl-Resten vor und das Iodid wird mit Hilfe des Enzyms Thyreoperoxidase (TPO) an die Tyrosyl-Reste gebunden; durch Bindung eines Iod-Atoms entsteht zunächst Monoiodtyrosin, durch Bindung eines weiteren Iod-Atoms dann Diiodtyrosin (DIT). Da die TPO Häm als prosthetische Gruppe enthält, kann die Synthese von MIT und DIT (und infolgedessen auch die der Schilddrüsenhormone) durch einen Eisenmangel eingeschränkt sein.[1][2][3][4]
Hormonvorstufe (Mensch)
[Bearbeiten]MIT liegt zusammen mit DIT in der Schilddrüse an Thyreoglobuline (TG) gebunden vor. Die Globuline bilden in dieser Form die unmittelbare Vorstufe der in der Schilddrüse produzierten Schilddrüsenhormone. Durch Zusammenlagerung (Koppelung über eine Etherbrücke[5]) im TG-Molekül von einem MIT- und einem DIT-Molekül wird T3 (ca. 11 μg/Tag[4]), durch Zusammenlagerung von zwei DIT-Molekülen T4 (ca. 100 μg/Tag[4]) gebildet. In der Schilddrüse wird T3 sowohl in Form von 3,5,3'-Triiodthyronin (T3, ca. 10 μg/Tag) als auch als inaktives[6] 3,3',5'-Triiodthyronin (rT3, für: reverses Triiodtyronin, ca. 1 μg/Tag) gebildet.[4] Auch bei diesen Koppelungsvorgängen ist wieder die Thyreoperoxidase beteiligt. [1][2][4]
Die entstandenen Hormone werden jedoch nicht frei, sondern in an Transportproteine (Thyroxin-bindendes Globulin|TBG, Transthyretin|TTR, Thyroxin-bindendes Albumin|TBA, Thyroxin-bindendes Präalbumin|TBPA, Sexualhormon-bindendes Globulin|SHBG) gebundener, inaktiver Form in den Blutkreislauf abgegeben. Sie liegen im Blut zu über 99% (T4 zu 99,95%, T3 zu 99,7%[1]) in an Proteine gebundener Form vor und erst bei Bedarf bildet der Körper aus den gebundenen Schilddrüsenhormonen freie, aktive Hormone. Dabei wird freies T4 (fT4) durch einfache Freisetzung des T4 aus seiner Eiweißbindung gebildet. Freies T3 (fT3) und inaktives[6] rT3 wird sowohl unmittelbar durch Freisetzung aus seiner Eiweißbindung, größtenteils aber mittelbar mit Hilfe von Thyroxindeiodasen im Zytoplasma der Zielzelle aus freiem, in die Zelle eingewandertem T4 durch Abspaltung eines Iod-Atoms
- an der 5'-Position (=T3, ca. 25 μg aus den 100 μg tgl. erzeugten T4)[4] oder
- an der 5-Position (=rT3, ca. 35 μg aus den 100 μg tgl. erzeugten T4)[4]
gewonnen. Da die Thyroxindeiodasen selenhaltige Enzyme sind, kann die Synthese von fT3 in den Zielzellen durch einen Selenmangel eingeschränkt sein. [1][2][3][4]
Es ist zu beachten, dass einerseits T4 den Großteil der in der Schilddrüse gebildeten Schilddrüsenhormone ausmacht, andererseits der Großteil des im Körper bzw. in den Zellen freigesetzten fT3 mittelbar aus in die Zielzelle eingewandertem fT4 hergestellt wird.[1][2][4][5] Somit ist MIT lediglich die unmittelbare Vorstufe des in geringen Mengen in der Schilddrüse produzierten T3, hauptsächlich aber mittelbare Vorstufe der aus DIT produzierten Schilddrüsenhormonanteile.
Weblinks
[Bearbeiten]- 3-Iodo-Tyrosine bei DrugBank
- Thyroperoxidase (EC 1.11.1.8) (engl.) bei ExPASy
- Thyroxine 5'-deiodinase (EC 1.97.1.10) (engl.) bei ExPASy
- Thyroxine 5-deiodinase (EC 1.97.1.11) (engl.) bei ExPASy
- Diiodotyrosine transaminase (EC 2.6.1.24) (engl.) bei ExPASy
Diiodtyrosin
[Bearbeiten]
Diiodtyrosin (DIT), veraltet auch Dijodtyrosin (DJT), ist eine nichteiweißbildende Aminosäure, die aus der proteinogenen Aminosäure L-Tyrosin durch Iodierung entsteht. Es ist im menschlichen Körper eine Vorstufe der Schilddrüsenhormone T3 und T4.
Verwendung
[Bearbeiten]Diiodtyrosin wird als Arzneimittel bei Schilddrüsenerkrankungen (Thyreostatikum) eingesetzt.[7] Darüberhinaus ist es ein Anti-Frost-Protein-Hemmer.[8]
Biologische Bedeutung
[Bearbeiten]Biosynthese (Mensch)
[Bearbeiten]Diiodtyrosin wird in der Schilddrüse aus L-Tyrosin und Iodid gebildet. Das L-Tyrosin liegt dabei in Form von an Thyreoglobulin gebundenen Tyrosyl-Resten vor und das Iodid wird mit Hilfe des Enzyms Thyreoperoxidase (TPO) an die Tyrosyl-Reste gebunden; durch Bindung eines Iod-Atoms entsteht zunächst Monoiodtyrosin (MIT), durch Bindung eines weiteren Iod-Atoms dann Diiodtyrosin. Da die TPO Häm als Bestandteil enthält, kann die Synthese von MIT und DIT (und infolgedessen auch die der Schilddrüsenhormone) durch einen Eisenmangel eingeschränkt sein.[1][2][3][4]
Hormonvorstufe (Mensch)
[Bearbeiten]Diiodtyrosin ist beim Menschen die Vorläufersubstanz des Schilddrüsenhormons L-Thyroxin (T4) und einer der Vorläufersubstanzen des Schilddrüsenhormons Triiodthyronin (T3).
DIT liegt zusammen mit MIT in der Schilddrüse an Thyreoglobuline (TG) gebunden vor. Durch Zusammenlagerung (Koppelung über eine Etherbrücke[5]) im TG-Molekül von einem MIT- und einem DIT-Molekül wird T3 (ca. 11 μg/Tag[4]), durch Zusammenlagerung von zwei DIT-Molekülen T4 (ca. 100 μg/Tag[4]) gebildet. In der Schilddrüse wird T3 sowohl in Form von 3,5,3'-Triiodthyronin (T3, ca. 10 μg/Tag) als auch als inaktives[6] 3,3',5'-Triiodthyronin (rT3, für: reverses Triiodtyronin, ca. 1 μg/Tag) gebildet.[4] Auch bei diesen Koppelungsvorgängen ist wieder die Thyreoperoxidase beteiligt. [1][2][4]
- DIT ist die Hauptvorstufe sowohl von (in den Zielzellen gebildetem) fT3 als auch von T4/fT4,
- MIT ist die unmittelbare Vorstufe des in geringen Mengen in der Schilddrüse produzierten T3, hauptsächlich aber mittelbare Vorstufe der aus DIT produzierten Schilddrüsenhormonanteile,
- fT4 die unmittelbare Hauptvorstufe von fT3.
Obwohl DIT Vorstufe von Schilddrüsenhormonen ist, kann es nicht durch vermehrte (künstliche) Zufuhr zur Steigerung der Schilddrüsenhormonproduktion verwendet werden, da es paradoxerweise als Thyreostatikum[7] wirkt.
Weblinks
[Bearbeiten]- 3,5-Diiodotyrosine bei DrugBank
- Thyroperoxidase (EC 1.11.1.8) (engl.) bei ExPASy
- Thyroxine 5'-deiodinase (EC 1.97.1.10) (engl.) bei ExPASy
- Thyroxine 5-deiodinase (EC 1.97.1.11) (engl.) bei ExPASy
- Diiodotyrosine transaminase (EC 2.6.1.24) (engl.) bei ExPASy
Thyreoperoxidase
[Bearbeiten]Speicherung von T3 und T4 in der Schilddrüse
[Bearbeiten]Thyreoglobin TG
[Bearbeiten]Follikel
[Bearbeiten]Kolloid
[Bearbeiten]Selen in der Schilddrüse
[Bearbeiten]Selen spielt eine wichtige Rolle bei der Produktion der Schilddrüsenhormone, genauer bei der „Aktivierung“ von Thyroxin (T4) zu Triiodthyronin (T3).
Selen ist Bestandteil eines Enzyms, der Thyroxin-5'-Deiodase, die für die Entfernung eines Iodatoms aus T4 verantwortlich ist. Durch diese Deiodierung entsteht T3. Ein Selenmangel führt zu einem Mangel an Thyroxin-5'-Deiodase, wodurch nur noch ein Teil des verfügbaren T4 deiodiert werden kann. Da T3 im Stoffwechsel wesentlich wirksamer ist, resultiert aus einem T3-Mangel eine Schilddrüsenunterfunktion. Eine zusätzliche Einnahme von Selenpräparaten (Natriumselenit) in hohen Dosen von 200–300 μg täglich ist nach ärztlicher Abklärung z. B. bei Hashimoto-Thyreoiditis wahrscheinlich sinnvoll, da damit die Höhe der Antikörpertiter reduziert werden kann. Ob die Ausbildung einer Hypothyreose verhindert werden kann, ist noch offen.[9]
Vergleiche dazu auch:
- D. Behne, A. Kyriakoupoulos, H. Meinhold, J. Köhrle: Identification of type I iodothyronine 5'-deiodinase as a selenoenzyme. In: Biochem. Biophys. Res. Comm. 173, 1143–1149, 1990 [1]
- J. R. Arthur, F. Nicol und G. J. Beckett: Selenium deficiency, thyroid hormone metabolism, and thyroid hormone deiodinases. In: Am. J. Clinical Nutrition, 57, 236–239, 1993 [2].
- C. Ekmekcioglu C: Spurenelemente auf dem Weg ins 21. Jahrhundert – zunehmende Bedeutung von Eisen, Kupfer, Selen und Zink. In: Journal für Ernährungsmedizin, 2 (2), 18–23, 2000,
Siehe *http://www.trace-elements.org/Service/Jod/Jod_und_Selen/jod_und_selen.html
Transport der SD Hormone im Blut
[Bearbeiten]L-Thyroxin (T4) liegt beim Menschen im Blut zu über 99,9 % an Transportproteine gebunden vor, nur etwa 0,03 % sind freies Hormon (fT4). Trijodthyronin (T3) ist ebenfalls zu über 99 % gebunden, etwa 0,3 % sind frei (fT3).
Das Thyroxin-bindendes Globulin (TBG) ist das wichtigste Transportprotein für Schilddrüsenhormone im Blut.
Weitere Proteine, die mit niedrigerer Affinität T4 und T3 binden können, sind Transthyretin (TTR) sowie unspezifisch auch Albumin oder Präalbumin. Dies macht einen kleineren Anteil aus. Auch SHBG (Sexualhormon-bindendes Globulin) vermag die Schilddrüsenhormone zu binden.
TBG besitzt zum eine außergewöhnlich hohe Bindungsaffinität zu Thyroxin (T4) und Trijodthyronin (T3). Außerdem weist es eine große Spezifität für T3 und T4 auf.
TBG
[Bearbeiten]
Die Primärstruktur von TBG besteht aus 395 Aminosäuren.[10] TBG besitzt einer Molekülmasse von etwa 54 kDalton. Es kann pro Molekül ein Molekül Schilddrüsenhormon binden. Seine Serum-Konzentration beträgt beim Menschen etwa 260 nmol/l (15 µg/ml). Da durch die Proteinbindung die schnelle Ausscheidung über die Niere verhindert wird, beträgt die biologische Halbwertszeit von T4 etwa 5 bis 8 Tage, für T3 nur etwa 19 Stunden, da es eine 10 bis 20fach geringere Affinität zu TBG hat und an Transthyretin überhaupt nicht bindet. Das biologisch inaktive rT3 hat eine noch geringere Bindung an die Serumproteine und daher nur eine Serum-Halbwertszeit von etwa vier Stunden.
Die Gesamt-Konzentration von T4 und T3 – nicht aber die Konzentration der biologisch wirksamen freien Hormone – hängt im Wesentlichen von der Konzentration und Zusammensetzung der Bindungsproteine ab.
Normalwerte
[Bearbeiten]TBG wird aus 1 ml Serum bestimmt.
Altersgruppe Normbereich -------------------------------------- Kinder bis 15 Jahre 2,0-3,0 mg/dl Erwachsene 1,6-3,0 mg/dl
TBG erhöht bei
[Bearbeiten]- Schwangerschaft
- Östrogenerhöhungen: z.B. Ovulationshemmer
- Androgene
- Hypothyreose
- konnatal: angeborener TBG-Exzeß: ~1:6000 bis 1:17.600 Geburten
- hereditärere TBG-Varianten mit veränderter Affinität zu T4 (sehr selten)
erniedrigt
[Bearbeiten]- kongenital: angeborener kompletter TBG-Mangel: Werte <5 mg/l ~1:15 000 Geburten
- partieller TBG-Mangel: ~1:5000 Geburten
- Eiweißverluste (enteral, renal)
Quellen
[Bearbeiten]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Abschnitt Physiologie in „Schilddrüse“ bei DPC-Bühlmann GmbH
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Aritikel „Jod“ im Lexikon für Orthomolekulare Medizin – Vitalstoff-Lexikon
- ↑ 3,0 3,1 3,2 Abschnitt 1.5.3 in Jörg Sasse: Dissertation: „Plasmakonzentrationen von Prolaktin, Cortisol, Trijodthyronin und Thyroxin bei Schlafentzug-Respondern unter Tryptophan-Depletion im Rahmen einer endogenen Depression“. Medizinische Fakultät Charité der Humboldt Universität zu Berlin, 10. Oktober 2000.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 4,12 4,13 Abschnitt 1.1.2 in Katarzyna Agata Fischmann: Inaugural-Dissertation: „Veränderungen der Schilddrüsenparameter TSH, fT3 und fT4 im Verlauf einer Entgiftungs-/Entwöhnungstherapie bei Alkoholkranken“. Medizinische Fakultät der Eberhard-Karls-Universität zu Tübingen, 2005.
- ↑ 5,0 5,1 5,2 Abschnitt 1.1.1 in Christoph Kraft: Inaugural-Dissertation: „Der Einfluß von Triiodtyronin auf die extrazelluläre Matrix von Rattenherzen und Rattennieren“. Fachbereich Humanmedizin der Justus-Liebig-Universität Giessen, 2001.
- ↑ 6,0 6,1 6,2 Thyroxine 5-deiodinase (EC 1.97.1.11) (engl.) bei ExPASy
- ↑ 7,0 7,1 ATC-H03BX01-Eintrag (engl.) bei ATC/DDD Index 2007
- ↑ 3,5-Diiodotyrosine (DB03374). in: DrugBank
- ↑ http://edoc.ub.uni-muenchen.de/archive/00000751/
- ↑ UniProt P05543
Transthyretin (TTR, Thyroxin bindendes Präalbumin, TBPA) ist ein Serumtransportprotein, das vorwiegend in der Leber gebildet wird. Es ist am Transport der Schilddrüsenhormone beteiligt.
Transthyretin (TTR) hat eine mäßig hohe Affinität und mäßig hohe Kapazität für T4, so dass es etwa 15 % des T4 bindet. Seine Bindungskapazität für T3 ist so niedrig, dass es kaum T3 bindet. Seine Konzentration im Serum liegt bei 250 mg/l. Es weist eine strukturelle Verwandtschaft mit verschiedenen gastrointestinalen Proteohormonen auf (Döcke, Friedemann 1994).
In der Serumelektrophorese wandert Transthyretin vor der Albuminfraktion (Präalbumin). Es ist beteiligt an der Bindung von Thyroxin und Retinol und hat eine molare Masse von ca. 55 kDa. Bei chronisch-aktiven Entzündungszuständen ist Transthyretin vermindert. Es wird daher als Anti- Akute-Phase-Protein bezeichnet.
Im Alter ist Transthyretin an der Entstehung der senilen Amyloidose beteiligt. Genetisch veränderte Varianten des Transthyretin können zu vererblichen Amyloidosen mit autosomal-dominantem Erbgang führen.
Transport durch Zellmembranen
[Bearbeiten]Schilddrüsenhormone sind lipophile (fettlösliche} Substanzen, so dass sie passiv durch Zellmembranen treten können. Dennoch gibt es beim Menschen mindestens 10 verschiedene aktive, energieabhängige und genetisch regulierbare Transporter (humane Iodothyronintransporter). Damit wird erreicht, dass der Spiegel von Schilddrüsenhormonen in der Zelle höher als im Blutplasma oder in Gewebeflüssigkeiten liegt[1].
Einzelnachweise
[Bearbeiten]- ↑ Dietrich, J. W., K. Brisseau und B. O. Boehm (2008). "Resorption, Transport und Bioverfügbarkeit von Schilddrüsenhormonen." Deutsche Medizinische Wochenschrift 133 (31/21): 1644-8. DOI 10.1055/s-0028-1082780 PMID 18651367
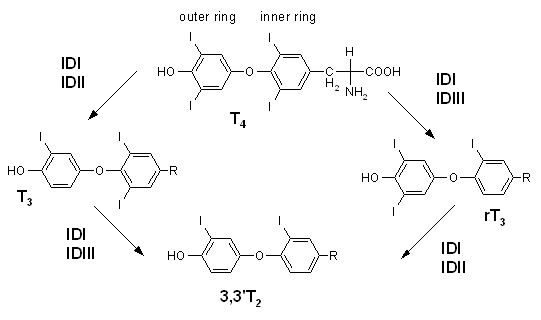
Umbau und Abbau der SD-Hormone
[Bearbeiten]Ein Enzym namens Dejodase spaltet aus dem T4 ein Jodatom ab und wandelt so die Hormonvorstufe T4 in das zehnfach aktivere T3 um.
Deiodase
[Bearbeiten]Die menschliche Typ I 5'-Deiodase sitzt vor allem in der Leber, Niere, Schilddrüse und Hypophyse. Sie ist ein Schlüsselenzym der Schilddrüsenhormonwirkung, da sie Thyroxin (T4) zum biologisch aktiven T3 umbaut.
Auch nach einer kompletten Entfernung der Schilddrüse reicht die Dejodase in den Organen außerhalb der Schilddrüse völlig aus, um genügend T3 aus dem T4 zu bilden.
Deiodase ist ein Selenoenzyme, d.h. Selen ist als Spurenelement in dem Emzym vorhanden.
Die Deiodase wird durch verschiedene Einflüsse in ihrer Aktivität verändert:
Bremsend auf die Dejodase wirken
[Bearbeiten]- verschiedene Tumoren,
- akute Entzündungsreaktionen
- "Niederes-T3-Syndrom"
- Amiodaron
Als Folge ist die T3-Bildung reduziert.
Grafik des Umbaus und Abbaus der Schilddrüsenhormone
Wirkung von T3 und T4
[Bearbeiten]T3 = Trijodthyronin T4 = Thyroxin
Schilddrüsenhormone sind für den Menschen und wohl alle höheren Tiere lebenswichtig
Schilddrüsenhormone sensibilisieren die Körperperipherie gegenüber den Katecholaminen Adrenalin und Noradrenalin.
Wachstum:
- Schilddrüsenhormonmangel führt zu Verzögerungen beim Knochenwachstum und bei der Gehirnreifung.
Energiestoffwechsel:
- Schilddrüsenhormone steigern den Zellstoffwechsel, d. h. den Grundumsatz und erhöhen den Sauerstoffverbrauch.
Eiweiß- und Kohlenhydratstoffwechsel:
- Physiologische Schilddrüsenhormonkonzentrationen fördern, erhöhte Konzentrationen hemmen die Protein- und Glykoproteinsynthese.
Fettstoffwechsel:
- Schilddrüsenhormonmangel verzögert den Cholesterinabbau, ein Hormonüberschuss beschleunigt ihn.
Mineralhaushalt:
- Phosphat- und Kalziumbilanz sind bei Hyperthyreose negativ, bei Hypothyreose positiv.
Herz und Kreislauf: Eine Überfunktion der Schilddrüse
- erhöht die Herzfrequenz,
- das Schlagvolumen und
- die Blutdruckamplitude.
Psyche:
- Eine Unterfunktion der Schilddrüse führt zur Apathie,
- eine Überfunktion zur Übererregbarkeit und manchmal zur Psychose
Muskulatur:
- Bei Hyper- und Hypothyreose kann eine Myopathie auftreten,
- bei einer Hypothyreose sind die Sehneneigenreflexe verlangsamt.
Es bestehen Wechselbeziehungen zwischen der Schilddrüse und anderen endokrinen Organen, nämlich Keimdrüsen und Nebenniere. Dies erklärt die Amenorrhoe bzw. habituelle Aborte bei einer Schilddrüsenfunktionsstörung.
Rezeptoren für Schilddrüsenhormone
[Bearbeiten]TR = thyroid hormone receptor
TRalpha
- wichtig für die postnatale Entwicklung
- und die kardiale Funktion
- DNS auf Chromosom 17
TRbeta
- kontrolliert die Entwicklung des Innenohrs und der Retina
- kontrolliert den Leberstoffwechsel
- kontrolliert die Spiegel der Schilddrüsenhormone
- DNS auf Chromosom 3
- Ursächlich für die periphere SDHormon Resistenz
- (resistance to thyroid hormone (RTH))
Molekulargenetische Diagnostik von Thyreoidea- Hormon-Rezeptor-ß (THRB, THR1, ERBA2) Resistenz
[Bearbeiten]Bei gleichzeitig erhöhten Schildrüsenhormonwerten (fT3, fT4) mit normalen (85%) oder leicht erhöhten (15%) TSH ist an eine THR-Resistenz zu denken. Das klinische Bild der Erkrankung ist sehr variabel. Generell findet man eine Struma, die von Hyperaktivität, Lern-, Hörstörungen, klassischen Symptomen einer Hyperthyreose (z.B. Tachyarrhythmie), Thyreotoxikose usw. bis zur Entwicklungsstörungen von ZNS und Skelett (z.B. Epiphysendysgenesie) begleitet werden kann.
Es gibt mindestens 4 bekannte Rezeptoren der Zielorgane von Schilddrüsenhormonen, die in unterschiedlicher Zusammensetzung gewebsspezifisch vorkommen, unter anderem den alpha-Rezeptor, der vorwiegend im ZNS vorkommt unnd dessen Gen auf dem Chromosom 17 - Bande q11.2- liegt und den ß-Rezeptor, dessen Gen auf dem Chromosom 3 - Bande p24.3- liegt und der hauptsächlich in Zellkernen der Leber vorkommt. Beide Gene sind auch als Tumorgene ERBA-1 bzw. ERBA-2 bekannt.
Molekulargenetische Defekte bei generalisierter THR-Resistenz sind für das THR-ß-Gen beschrieben. Einige Fälle sind sporadisch, wenige auch rezessiv erblich. Die meisten folgen einem dominanten Erbgang (Verlust der Rezeptorfunktion bei Mutation in einer Bindungsdomäne).
Je nach Art der Mutation im THR-ß-Gen können verschiedene Phänotypen auftreten, die darüber hinaus von bisher unbekannten Fktoren zusätzlich variiert werden. Genaue Zahlen über die Häufigkeit der THR-Resistenz sind gegenwärtig nicht bekannt.
Untersuchungsmaterial:
[Bearbeiten]- 5 - 10 ml EDTA-Blut
- Die Proben sollten umgehend auf dem normalen Postwege zugesandt werden.
- Der Befund liegt nach etwa 4 - 6 Wochen vor.
Literatur
[Bearbeiten]- Yen PM, Ando S, Feng X, Liu Y, Maruvada P, Xia X.
- Thyroid hormone action at the cellular, genomic and target gene levels.
- Mol Cell Endocrinol. 2006 Feb 26;246(1-2):121-7. Epub 2006 Jan 25. Review.
- PMID: 16442701
- Thyroid hormone action at the cellular, genomic and target gene levels.
- O. E. Janssen Medizinische Klinik, Klinikum Innenstadt, Ludwig-Maximilians-Universität München, XX
- Resistenz gegen Schilddrüsenhormone
- Der Internist Verlag Springer Berlin / Heidelberg
- Heft Volume 39, Number 6 / Juni 1998 Seiten 613-618
- Resistenz gegen Schilddrüsenhormone
Regelkreis der Schilddrüsenhormonproduktion
[Bearbeiten]Die Freisetzung von Schilddrüsenhormonen wird durch einen mehrschleifigen Regelkreis gesteuert. Man spricht von einer Hierarchie der Hormonregulation.
Die oberste Stufe der Hierarchie befindet sich im Hypothalamus, einem Teil des Gehirnes, welcher auch für andere Hormonsysteme des Körpers die Schaltstelle zwischen Nervensystem und Hormonsystem darstellt. Im Hypothalamus werden sogenannte Releasing-Faktoren gebildet, die in nachgeordneten endokrinen Drüsen die Freisetzung von Hormonen anregen. Einer dieser Freisetzungsfaktoren ist TRH, Thyreotropin-Releasing Hormone. Es bewirkt eine Freisetzung von TSH (Thyreotropin) in der Hypophyse, der Hirnanhangsdrüse. Über diese Zwischenstufe wird dann letztendlich die Schilddrüse selbst angeregt, ihre Hormone T3 und T4 auszuschütten.
Steigt der Hormonspiegel im Blut an, dann erhält der Hypothalamus und die Hypophyse über eine Gegenkoppelung (hemmende Rückkoppelung) die Information: Es ist genügend Hormon im Blut vorhanden. Als Folge wird die Ausschüttung der Freisetzungshormone TRH und TSH wieder zurückgefahren.
Weitere Schleifen des Regelkreises umfassen z. B. einen Ultrashort-Feedback-Mechanismus von TSH auf seine eigene Ausschüttung (Brokken-Wiersinga-Prummel-Regelkreis) und ein Long-Feedback von T4 auf TRH.
Hierarchie der Schilddrüsenhormone
[Bearbeiten] Hypothalamus TRH - Nervenzellen <----
| |
TRH |
| |
| |
V |
Hypophysenvorderlappen <<<-----------|
| | * |
TSH ------- |
| Rückkopplung ( Bremsung der oberen Ebene)
| |
V |
Schilddrüse |
| |
T3,T4 -------->>-------------------
|
|
V
Körperzellen * Prummel-Wiersinga-Regelkreis
Siehe auch
Literatur
[Bearbeiten]- Der Hypophysen-Schilddrüsen-Regelkreis: Entwicklung und klinische Anwendung eines nichtlinearen Modells. Spektrum medizinischer Forschung, Bd. 2 (Taschenbuch)
- von Johannes W. Dietrich (Autor)
- Taschenbuch: 195 Seiten Logos Verlag Berlin (2002) ISBN 3897228505
- von Johannes W. Dietrich (Autor)
TRH
[Bearbeiten]TRH ist die Abkürzung für Thyrotropin releasing Hormon. TRH ist ein Freisetzungshormon, das im Hypothalamus, einem Teil des Gehirnes, gebildet wird. Über das hypothalamisch-hypophysäre Pfortadersystem wird TRH zur Hirnanhangsdrüse (Hypophyse) transportiert. In der Hypophyse stimuliert TRH die Bildung und die Ausschüttung von TSH, dem sogenannten Thyreoidea Stimulierenden Hormon und darüber indirekt auch die Ausschüttung von T3 und T4 in der Schilddrüse.
Neben seiner Hauptwirkung auf die Hypophyse stimuliert TRH auch die Freisetzung von Prolaktin, einem Hormon, welches die Milchproduktion der weiblichen Brust anregt.
Bei Patienten mit Akromegalie oder Riesenwuchs kommt es in etwas der Hälfte der Fälle nach TRH-Gabe zu einem Anstieg der Wachstumshormon-Sekretion. Bei gesunden Personen wird dies nicht beobachtet.
Die Struktur des TRHs wurde 1969 erstmals von den Forschergruppen Guillemin und Schally veröffentlicht.
Es handelt sich um ein L-pyroglutamyl-L-histidyl-L-prolinamid (L-pGlu-L-His-L-ProNH2).
Siehe auch : *[3]
Ein größerer Teil des TRHs hat eine direkte Wirkung im Gehirn, die nichts mit der Wirkung im Schilddrüsenregelkreis zu tun hat. So erklärt sich auch die geringe bremsende Wirkung eines erhöhten Blutspiegels von T3 und T4 auf den TRH Spiegel.
TRH ist als Neurotransmitter im Gehirn
- an der Thermoregulation,
- an der Schmerzunterdrückung
- an der Schlaf-Wachregulation
- an der Bremsung von Nahrungs- und Flüssigkeitsaufnahme
und an einer Vielzahl weiterer Steuerungsvorgänge beteiligt.
TRH hat auch indirekte vegetative Wirkungen:
- Es stimuliert über den Vagusnerv die Magensäureproduktion und die Magen-Darm-Peristaltik
- Es stimuliert über den Sympathikus die Insulinsekretion
- Es stimuliert daneben auch die Bauchspeicheldrüse in ihrer exokrinen Funktion.
- Es steigert Herzfrequenz und Blutdruck.
TSH
[Bearbeiten]
Thyreotropin, auch thyreotropes Hormon oder Thyroidea-stimulierendes Hormon (TSH), ist ein Hormon des Hypophysenvorderlappens mit stimulierender Wirkung auf die Schilddrüse für die Hormonproduktion.
Der am weitesten verbreitete Name für das Hormon ist die Abkürzung TSH.
TSH wird in den basophilen Zellen des Hypophysenvorderlappens gebildet. Es ist ein Proteohormon, d.h. es besteht aus einer längeren Kette von Aminosäuren, und hat ein Molekulargewicht von ca. 28.000 Dalton. TSH regt die Schilddrüse zu vermehrter Hormonproduktion an.
Physiologie
[Bearbeiten]Mit Hilfe des Releasing-Hormons Thyreoliberin (TRH), das durch ein besonderes Portalgefäßsystem in hoher Konzentration zum Hypophysenvorderlappen gelangt, stimuliert der Hypothalamus die Ausschüttung von TSH aus den thyreotropen Zellen. TSH regt dann in der Schilddrüse die Bildung der jodhaltigen Schilddrüsenhormone Thyroxin (T4) und Trijodthyronin (T3) an, zudem fördert es in der Peripherie die Umwandlung von T4 in das wirksamere T3. Umgekehrt hemmen Schilddrüsenhormone im Rahmen des thyreotropen Regelkreises die Ausschüttung von TSH aus dem Hypohysenvorderlappen, so daß schließlich konstante und bedarfsadaptierte Gleichgewichtsspiegel der beteiligten Hormone erreicht werden.
TSH-Mangel, TSH-Überproduktion
[Bearbeiten]Fehlt TSH oder kann es nicht ausreichend produziert werden, dann wird die Schilddrüse immer kleiner und verkümmert. Es resultiert eine hypophysäre Hypothyreose = sekundäre Schilddrüsenunterfunktion.
Produziert die Hypophyse beispielsweise wegen eines TSH produzierenden Adenoms zu viel TSH, dann resultiert eine Schilddrüsenüberfunktion, die man als hypophysäre Hyperthyreose oder auch sekundäre Hyperthyreose bezeichnet.
Diese sekundären Schilddrüsenfunktionsstörungen wegen eines TSH-Mangels oder einer TSH-Überproduktion sind selten.
Schließlich kann es durch Störungen der TRH-Sekretion von seiten des Hypothalamus oder der Signalübermittlung im hypothalamo-hypohysären Portalgefäßsystem (Pickardt-Syndrom) zu sekundären TSH-Mangelerscheinungen oder -überproduktionen und damit zu den sehr seltenen tertiären Hypo- oder Hyperthyreosen kommen.
TRAK hat TSH Wirkung
[Bearbeiten]Erstaunlicherweise hat ein Immunglobulin, welches v.a. bei der autoimmunen Erkrankung Morbus Basedow vermehrt produziert wird (jedoch auch bei an Hashimoto-Thyreoiditis erkrankten Personen vorkommen kann), eine ähnlich stimulierende Wirkung an der Schilddrüse wie das TSH. Dieser Antikörper wird als TRAK = Thyreoidea Rezeptor Antikörper bezeichnet.
Normwerte im Blutserum:
[Bearbeiten]bei vorhandener Schilddrüse:
TSH: 0,3 - 2,5 mU/l
(Der obere Referenzwert wurde 2003 überarbeitet, er war vorher - und ist es in vielen Laborbefunden auch noch 2006 - bis 4,0 mU/l. Grund war die Beobachtung, dass viele Probanden mit TSH-Werten zwischen 2,5 und 4 mU/l zwar zum Bestimmungszeitpunkt gesund waren, bei Langzeitnachuntersuchungen aber eine hohe Tendenz zeigten, später an Autoimmunthyreoiditis zu erkranken. Deshalb wird bei diesen Werten empfohlen, von Zeit zu Zeit auf Antikörper zu testen.)
bei operierter Schilddrüse mit Hormonersatztherapie:
TSH: 0,3 - 1,0 mU/l
TSH kann im Blut bestimmt werden. Bei der primären Schilddrüsenunterfunktion Hypothyreose ist es reaktiv erhöht. Bei der primären Schilddrüsenüberfunktion ist es erniedrigt.
TRH-Test
[Bearbeiten]Mittels des TRH-Tests kann die Stimulierbarkeit des TSH in der Hypophyse überprüft werden. Es werden zwei TSH-Bestimmungen im Abstand von etwa 30 Minuten vorgenommen. Unmittelbar nach der ersten Blutentnahme wird TRH zugeführt (heute zumeist via Nasenspray). Die TRH Gabe von außen regt die TSH-Bildung an, so dass die zweite TSH-Bestimmung in jedem Fall höhere Werte liefert. Hierbei wird eine Erhöhung (2. TSH-Wert minus 1. TSH-Wert) zwischen 2 und 16 mU/l als "normal" eingestuft. Erhöhungen oberhalb von 16 mU/l definieren eine Sonderform der subklinischen Hypothyreose (engl. "Grade 3 Hypothyroidism").
Nach derzeit vorherrschender Lehrmeinung wird der TRH-Test als "weitgehend überflüssig" eingestuft. Als Begründung wird dafür vor allem die heute mögliche hohe Genauigkeit der TSH-Bestimmungsverfahren (zwei Nachkommastellen und höher) angegeben.
Geschichte
[Bearbeiten]- TSH wurde 1929 durch Aron und Löb entdeckt.
- TSH wurde von??? sequenziert.
- 1965 wurde ein erster Radioimmuno-Assay für TSH durch Odell beschrieben.
(Radioimmunoassay of thyrotropin in human serum Odell,W.D., J.F.Wilber,E.E.Paul J.clin. endocr.; Vol: 25, 1965 (1179))
- Seit kurzem gibt es rekombinantes TSH, welches beispielsweise bei der Nachsorgediagnostik des Schilddrüsenkarzinomes eingesetzt wird.
Calcitonin
[Bearbeiten]Das Calcitonin (syn. Kalzitonin, Thyreocalcitonin) ist ein Hormon, das bei Säugetieren in den C-Zellen der Schilddrüse gebildet wird. Bei den übrigen Wirbeltieren erfolgt die Bildung im Ultimobranchialen Körper. Calcitonin reguliert zusammen mit dem Parathormon und dem Vitamin D den Calcium- und Phosphathaushalt des Körpers.
Mit dem Calcitonin verwandt ist das Calcitonin gene related peptide (CGRP). Beide gehen auf ein gemeinsames pimäres mRNA-Transkript zurück. Durch gewebespezifisches alternatives splicen wird in der Schilddrüse vorwiegend Calcitonin gebildet, während im Zentralnervensystem und im peripheren Nervensystem in sensorischen Neuronen hauptsächlich CGRP hergestellt wird.
Geschichte
[Bearbeiten]Calcitonin wurde 1961 von Copp und Cameron entdeckt.
Struktur
[Bearbeiten]Beim menschlichen (hCT) Calcitonin handelt sich um ein Polypeptid aus 32 Aminosäuren mit einem Molekulargewicht von circa 3420 Dalton.
Primärsequenz: H-Cys-Ser-Asn-Leu-Ser-Thr-Cys-Val-Leu-Gly-Lys-Leu-Ser-Gln-Glu-Leu-His-Lys-Leu-Gln-Thr-Tyr-Pro-Arg-Thr-Asp-Val-Gly-Ala-Gly-Thr-Pro-NH2
Eine Ringstruktur gebildet durch eine Disulfidbrücke zwischen Cys1 und Cys7 und ein amidierter C-Terminus (Prolinamid) sind wichtig für die biologische Aktivität. CT(8-32) ohne die Ringstruktur bindet zwar an den Calcitonin-Rezeptor, bewirkt aber keine Rezeptoraktivierung, sondern wirkt als kompetitiver Antagonist.
Siehe http://www.personal.psu.edu/users/s/m/smk249/calcitonin.gif
Regulation und Wirkung
[Bearbeiten]Die Calcitoninfreisetzung wird stimuliert durch:
- hohes Calcium
- gastrointestinale Hormone,
- Pentagastrin
Calcitonin senkt den Blutcalciumspiegel. Es hemmt die Calciumfreisetzung aus dem Knochen (Osteoklasten werden gebremst). Außerdem erhöht es die Calcium-Ausscheidung über die Niere.
Calcitonin hat in höherer Dosierung beim Menschen eine diuretische Wirkung. Diese vermehrte proximale Natriurese wird circa 80 Minuten nach der intravenösen Calcitoningabe durch eine vermehrte distale Natriumreabsorption wieder ausgeglichen.
Im Vergleich zu den anderen calciumregulierenden Hormonen Parathormon (PTH) und D-Hormon (Calcitriol) scheint Calcitonin allerdings eine stark untergeordnete Rolle zu spielen.
Therapie
[Bearbeiten]Calcitonin wird als Lachscalcitonin zur Senkung stark erhöhter Calciumspiegel eingesetzt. Außerdem wirkt es bei Knochenmetastasen schmerzlindernd. Als Nebenwirkung kann dabei ein Flush auftreten.
Blutspiegel
[Bearbeiten]Das Calcitonin wird als Tumormarker beim medullären Schilddrüsenkarzinom verwendet.
Der Normalwert bei Erwachsenen ist kleiner als 100 ng/l.
Einen zu niedrigen Calcitoninwert findet man bei einer Schilddrüsenunterfunktion.
Einen zu hohen Wert findet man bei:
- manchmal bei der Schilddrüsenüberfunktion
- beim medullären Schilddrüsenkarzinom
- Niereninsuffizienz
- Leberzirrhose
Literatur
[Bearbeiten]- Azria, M.: Calcitonins. Physiology and Pharmacology. Freiburg 1988.
- Keck, E.: Calcitonin und Calcitonintherapie. Stuttgart 1996.
Links
[Bearbeiten]- Gut verständliche Zusammenfassung
- Roche Lexikon
- http://www.igb.fhg.de/WWW/GF/MolBiotech/pharmaproteine/dt/Calcitonin.html
- synthetisches Calcitonin
- Ärzteblatt
- Muß man bei einer Struma nodosa Calcitonin mitbestimmen ??

